Den utskrivbara versionen stöds inte längre och kanske innehåller renderingsfel. Uppdatera din webbläsares bokmärken och använd standardutskriftsfunktionen istället.
| Krypton |
 |
|
|
|---|
| Allmänt |
|---|
| Ämnesklass | ädelgaser |
|---|
| Densitet | 3,708 kg/m3 (273 K) |
|---|
| Utseende | färglös |
|---|
|
|
| Atomens egenskaper |
|---|
| Atommassa | 83,798 u |
|---|
| Atomradie (beräknad) | inga data (88) pm |
|---|
| Kovalent radie | 110 pm |
|---|
| van der Waalsradie | 202 pm |
|---|
| Elektronkonfiguration | [Ar]3d104s24p6
 |
|---|
| e– per skal | 2, 8, 18, 8 |
|---|
| Oxidationstillstånd (O) | 0 (okänd) |
|---|
| Kristallstruktur | Kubisk tätpackning (ccp)
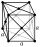 |
|---|
| Ämnets fysiska egenskaper |
|---|
| Aggregationstillstånd | gas |
|---|
| Smältpunkt | 115,79 K (-157,42 °C) |
|---|
| Kokpunkt | 119,93 K (-153,22 °C) |
|---|
| Molvolym | 27,99 ·10-6 m3/mol |
|---|
| Ångbildningsvärme | 9,029 kJ/mol |
|---|
| Smältvärme | 1,638 kJ/mol |
|---|
| Ljudhastighet | 1120 m/s vid 293,15 K |
|---|
| Diverse |
|---|
| Elektronegativitet | 3,00 (Paulingskalan) |
|---|
| Värmekapacitet | 248 J/(kg·K) |
|---|
| Värmeledningsförmåga | 0,00949 W/(m·K) |
|---|
| 1a jonisationspotential | 1350,8 kJ/mol |
|---|
| 2a jonisationspotential | 2350,4 kJ/mol |
|---|
| 3e jonisationspotential | 3565 kJ/mol |
|---|
| 4e jonisationspotential | 5070 kJ/mol |
|---|
| 5e jonisationspotential | 6240 kJ/mol |
|---|
| 6e jonisationspotential | 7570 kJ/mol |
|---|
| 7e jonisationspotential | 10710 kJ/mol |
|---|
| 8e jonisationspotential | 12138 kJ/mol |
|---|
| Stabilaste isotoper |
|---|
| Isotop
|
F %
|
Halv.tid
|
Typ
|
Energi (MeV)
|
Prod.
|
| 78Kr
|
0,35 %
|
78Kr, stabil isotop med 42 neutroner
|
| 80Kr
|
2,25 %
|
80Kr, stabil isotop med 44 neutroner
|
| 81Kr
|
syntetisk
|
229000 år
|
ε
|
0,281
|
81Br
|
| 82Kr
|
11,6 %
|
82Kr, stabil isotop med 46 neutroner
|
| 83Kr
|
11,5 %
|
83Kr, stabil isotop med 47 neutroner
|
| 84Kr
|
57 %
|
84Kr, stabil isotop med 48 neutroner
|
| 85Kr
|
syntetisk
|
10,756 år
|
β-
|
0,687
|
85Rb
|
| 86Kr
|
17,3 %
|
86Kr, stabil isotop med 50 neutroner
| |
| SI-enheter & STP används om ej annat angivits. |
Krypton är ett icke-metalliskt grundämne som har atomnummer 36 och kemiskt tecken Kr. Krypton är en ädelgas som är relativt sällsynt i jordens atmosfär. Krypton är precis som de andra ädelgaserna ovillig att bilda kemiska föreningar med andra ämnen men kan reagera med fluor och bilda instabila fluorider.
Historia
Krypton upptäcktes 1898 av de två forskarna Morris William Travers och William Ramsay. De försökte upptäcka den ädelgas som fanns mellan helium och argon genom att utgå från en liter flytande luft där det mesta av kvävet och syret fick avdunsta och sedan befriades gasen från restsyre och restkväve med glödande koppar och magnesium. När de sedan undersökte gasens spektrum, fann de en skarp grön linje och en gul-grön linje. De döpte gasen till krypton efter ett grekiskt ord som betyder gömd. Men när de bestämde gasens atomvikt, var den 84 och inte cirka 20, som de trodde den skulle vara. Detta innebar att gasen hörde hemma efter argon i det periodiska systemet. Den gas forskarna först trodde det var, med atomvikten cirka 20, hittades några veckor senare av samma forskare och döptes till neon.
Förekomst
Krypton är en ovanlig gas som förekommer till 0,0001 % eller 1 ppm i atmosfären.
| Ädelgas |
Andel i atmosfären
|
| Neon |
0,00153%
|
| Argon |
0,934%
|
| Krypton |
0,0001%
|
| Xenon |
0,000005%
|
Framställning
Krypton framställs som de flesta andra ädelgaser genom fraktionerad destillation av luft.
Användning

Ett kryptonfyllt glasrör lyser upp med hjälp av elektrisk ström och bildar förkortningen för krypton.
Krypton används i en del glödlampor då krypton har lägre värmeledningsförmåga än argon och ger glödtråden högre temperatur och ljusstyrka. Krypton används också i värmeisolerande fönster på grund av sin låga värmeledningsförmåga.
Kryptonfluorid-lasrar
I kryptonfluorid-lasrar tillförs en viss mängd energi till kryptongas blandad med fluorgas som då bildar en instabil fluorid. När energitillförseln upphör sönderfaller kryptonfluoriden och avger ultraviolett ljus.
Se även



